portant; word-wrap: break-word !important;"> 根据上述工作原则,现公开向社会征求《保健食品卫生学理化检验规范(征求意见稿)》意见和建议。欢迎相关单位和个人提出意见和建议,并请于2019年7月10日前,将《意见反馈表》(附件2)通过电子邮件反馈至ningxiao@nifdc.org.cn。
portant; word-wrap: break-word !important;">
portant; word-wrap: break-word !important;"> 附件:1.《保健食品卫生学理化检验规范(征求意见稿)》
portant; word-wrap: break-word !important;"> 2.意见反馈表
portant; word-wrap: break-word !important;">
附件1:


第一部分
总则
General Principles
一、主题内容和适用范围
Content and Scope of Application
1.本规范规定了保健食品和原料的卫生学技术要求的检验项目及方法。
2.本规范适用于保健食品的注册、复核和备案检验、监督抽验、风险监测及常规检验项目的确定和方法的选择。
二、基本要求
Basic Requirements
1. 凡保健食品,应符合GB 16740《食品安全国家标准 保健食品》的各项要求。附表1所列检测项目是对该标准的补充规定。
2. 保健食品中食品添加剂的使用应符合GB 2760的规定和(或)有关规定。检测机构可根据实际需要,按产品配方检测合成色素、防腐剂、甜味剂及抗氧化剂的含量。
3. 保健食品的包装材料应符合GB 4806.1《食品安全国家标准 食品接触材料及制品通用安全要求》的要求。
4. 进行辐照灭菌的产品,其辐照源、辐照剂量等均应符合相应的国家标准、行业标准或有关要求。
5. 检验机构受理保健食品检测时,申报单位应提供该产品的配方、工艺、产品技术要求及功效成分/标志性成分检测方法研究验证等相关资料。
6. 申请单位在对产品进行功效成分/标志性成分检测时,如国家标准中所提供的检测方法不适用于该产品检验时,可优先选择本规范第二部分提供的检测方法,并进行必要的方法学适用性研究;如规范中所提供的检测方法不适用于该产品检验时,申请单位可选择行业标准、国际上权威分析方法进行测定,并进行必要的方法适用性研究。注册检验机构对所附材料进行审核,必要时进行有关验证和方法确认,如申报单位提供的方法不适合送检的样品时,注册检验机构不得擅自修改,应将有关情况反馈申报单位,由其进行研究并提供方法后,再对送检样品进行试验,确保试验方法与送检产品技术要求中规定的方法一致。复核检验机构应按照申报单位提交的检验方法进行检验并出具复核检验报告。
7. 保健食品中原料和辅料应符合《保健食品注册与备案管理办法》中原、辅料质量要求的规定,并符合相应的食品国家标准。原料若为植物提取物或者原料及辅料加工过程中使用、间接引入有机溶剂时,涉及的有机溶剂应符合GB 2760《食品安全国家标准 食品添加剂使用标准》附录C中食品工业用加工助剂使用名单规定,或其他相关标准的要求。企业可根据产品质量控制需要,采用本规范中第三部分保健食品中十一种溶剂残留的测定方法将溶剂残留检测列入原料及产品的技术要求。
8. 针对各类功效的保健食品,需参照本规范第四部分兴奋剂及违禁成分测定方法进行非法添加筛查。同时,需进行配方分析,如明确存在原料带入情况的指标,应检测相关项目,报出检测结果,但不作为非法添加结果报送,除结果异常外。
9. 不同剂型及特定原料类别产品的卫生学理化检验应包括本规范第五部分中规定的相应检测项目。
10. 保健食品应具有与产品配方和申报的保健功能相适应的功效成分或标志性成分,申报时须提供配方中主要原料所含的功效成分或标志性成分的检测结果、检方法及方法学验证结果。第六部分列出了原料类型及相应检测项目,以所列原料为主的产品须检测表中规定的项目。
11. 普通食品形态产品应检测并制定净含量及允许负偏差指标,需要按照产品质量标准规定规格的最小包装确定检测依据,指标应符合《定量包装商品净含量计量检验规则》(JJF 1070)规定;《中国药典》“制剂通则”项下有相应要求的产品剂型,应检测并制定装量差异或重量差异指标,指标应符合规定。装量或净含量只检测内容物,不包括隔离材料,如胶囊壳等。
12. 最小服用单元含有惰性隔离材料填充的产品,如胶囊,其功效成分或者指标成分、农药残留、水分、灰分等指标以去除隔离材料(胶囊壳)的内容物为检测单元,对于非法添加药物、重金属、铬、色素(如材料带颜色)等则需要进行整体检测,或者检测结果明确标识相关检测部位。
13. 标准规定不得检出的项目结果,方法定量限以上检测结果,按照具体检出值报送结果;方法检出限以下检测结果,注明“未检出,检出限值”;方法检出限以上、定量限以下检测结果,注明“检出且小于定量限,定量限值,检出限值”。
14. 注册检验机构应按照国家相关规定和标准等要求,根据样品具体情况,合理地进行稳定性试验设计和研究。通过稳定性试验,考察样品在不同环境条件下(如温度、相对湿度等)的感官、化学、物理及生物学特征随时间增加其变化程度和规律,从而判断样品包装、贮存条件和保质期内的稳定性。产品稳定性重点考察指标,主要包括鉴别、感官、微生物、崩解时限(溶散时限、溶化性等)、水分、pH值、酸价、过氧化值、真菌毒素、列入理化指标中的功效成分/标志性成分等随储存条件和储存时间容易发生变化的指标。产品非稳定性重点考察指标,主要包括灰分、污染物(如铅、总砷、总汞等)、农残(如六六六、滴滴涕等)、国家相关标准及现行规定有用量限制的合成色素和甜味剂等随储存条件和贮存时间不易发生变化的指标,以及国家相关标准及现行规定有用量限制的抗氧化剂指标。
第二部分
二十五种功效成分和标志性成分
检验方法
Testing Methods for 25 kinds of Functional
and Iconic Components
一、保健食品中红景天苷的测定
Determination of salidroside in health food
1 范围
本方法规定了以红景天为主要原料的保健食品中红景天苷的液相色谱测定方法。
本方法适用于保健品食品中红景天苷的测定,也适用于保健食品中酪醇的测定。
2 原理
试样经甲醇超声提取,以0.01 mol/L 乙酸铵-甲醇为流动相(80+20),采用高效液相色谱法,紫外检测器检测,根据保留时间定性,外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T6682 规定的一级水。
3.1 试剂
3.1.1 乙酸铵(CH3COONH4 )。
3.1.2甲醇(CH3OH):色谱纯。
3.1.3甲醇(CH3OH)。
3.2试剂配制
乙酸铵溶液 (0.01mol/L):称取0.77 g乙酸铵,加入适量水溶解,用水定容至1000 mL,经0.45 μm水相微孔滤膜过滤后备用。
3.3标准品
红景天苷(C14H20O7):纯度≥98%。
酪醇(C8H10O2):纯度≥98%。
3.4标准溶液的配制
3.4.1 红景天苷标准储备液(2.0mg/mL): 准确称取红景天苷标准品0.02 g于 10 mL 容量瓶中,用甲醇(3.1.2)溶解并定容至刻度 ,摇匀。
3.4.2 红景天苷标准工作液:将红景天苷标准储备液(3.4.1)用甲醇(3.1.2)稀释制备一系列标准溶液,标准系列浓度为0mg/mL、0.01 mg/mL、0.02 mg/mL、0.05mg/mL、0.20 mg/mL、0.50 mg/mL,临用时配制。
3.4.3 酪醇标准储备液(2.0 mg/mL):准确称取酪醇标准品0.02 g于 10 mL 容量瓶中,用甲醇(3.1.2)溶解并定容至刻度 ,摇匀。
3.4.4 系统适用性溶液:准确吸取红景天苷标准储备液(3.4.1)和酪醇标准储备液(3.4.3)各0.5mL于 10 mL 容量瓶中,用甲醇(3.1.2)稀释至刻度,摇匀。
4 仪器设备
4.1 高效液相色谱仪: 配有紫外检测器(UV)。
4.2 超声波清洗器。
4.3 分析天平:感量为0.01 mg,0.1 mg。
5 分析步骤
5.1 试样制备
5.1.1 固体样品:取20粒以上片剂或胶囊试样进行粉碎、混匀,准确称取适量试样(约含红景天苷2.5mg)于 25 mL 容量瓶中,加入甲醇(3.1.3)约20mL,超声提取30 min,放冷至室温,用甲醇(3.1.3)定容至刻度。混匀后经0.45 μm滤膜过滤,供液相色谱分析用。
5.1.2 液体样品:准确吸取适量摇匀后的试样(约含红景天苷2.5mg)于25 mL容量瓶中,用甲醇(3.1.3)定容至刻度。混匀后经0.45 μm滤膜过滤,供液相色谱分析用。
5.2 色谱参考条件
5.2.1 色谱柱:C18柱,柱长250mm,内径4.6mm,填料粒径5 μm,或同等性能色谱柱;
5.2.2 流动相:乙酸铵溶液(0.01 mol/L)-甲醇(80+20);
5.2.3 流速:1.0 mL/min;
5.2.4 柱温:25 ℃;
5.2.5 检测波长:215 nm;
5.2.6 进样量:10 mL。
5.2.7 系统适用性试验:取系统适用性溶液(3.4.4)10 mL,注入液相色谱仪,记录色谱图,红景天苷峰与酪醇峰的分离度应大于1.5。
5.3标准曲线的制作
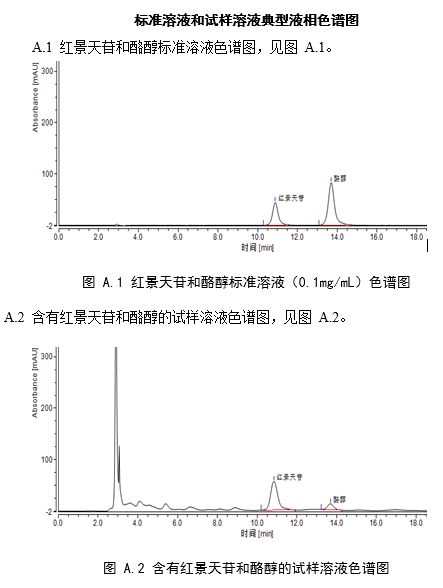
将标准系列工作液(3.4.2)分别注入高效液相色谱仪中,测定相应的色谱峰高或峰面积,以标准工作液的浓度为横坐标,以峰面积或峰高为纵坐标,绘制标准曲线(标准溶液液相色谱图见附录A中图A.1)。
5.4 试样溶液的测定
将试样待测液(5.1.1或5.1.2)注入液相色谱仪中,以保留时间定性,测得峰面积或峰高,根据标准曲线得到待测液红景天苷的浓度(样品溶液液相色谱图见附录A中图A.2)。
6 分析结果的表述
试样中红景天苷含量按式(1)计算:
C ×V
X = × 100 .......................................(1)
m
式中:
X-试样中红景天苷的含量,单位为毫克每百克或毫克每百毫升(mg/100g或mg/100mL);
C—由标准曲线查得待测样液中红景天苷的浓度,单位为毫克每毫升(mg/mL);
V—样品的定容体积,单位为毫升(mL);
m—样品量,单位为克或毫升(g或mL);
100—单位转换。
计算结果以重复条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的 10%。
8 其他
当称样量为 1 g,定容体积为 25 mL时,红景天苷的检出限为50m g/g。
附录 A
第三部分
十一种溶剂残留的测定
Determination of 11 kinds of
Residual Organic Solvents
1 范围
本标准规定了保健食品中甲醇、正丁醇、异丁醇、氯仿、正己烷、甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯和二乙烯苯11种溶剂残留的气相色谱测定方法。
本标准适用于保健食品中甲醇、正丁醇、异丁醇、氯仿、正己烷、甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯和二乙烯苯11种溶剂残留的测定。
2 原理
样品经50% N,N-二甲基甲酰胺溶液提取后,采用顶空-气相色谱法测定,用外标法定量。
3 试剂和材料
注:除非另有说明,本方法所用试剂均为分析纯,水为 GB/T6682 规定的一级水。
3.1 试剂
N,N-二甲基甲酰胺(HCON(CH3)2):色谱纯
3.2 试剂配置
50%的N,N-二甲基甲酰胺溶液: 500 mL N,N-二甲基甲酰胺与500 mL水充分互溶混合。
3.3 标准品
甲醇(CH4O)、正丁醇(CH3(CH2)3OH)、异丁醇(CH3CH(CH3)CH2OH)、氯仿(CHCl3)、正己烷(C6H14)、甲苯(C7H8)、对二甲苯(C8H10)、邻二甲苯(C8H10)、苯乙烯(C8H8)、1,2-二乙基苯(C10H14)和二乙烯苯(C10H10)标准品:纯度≥97.0%。
3.4 标准溶液的配制
3.4.1标准储备液:分别准确称取2500 mg(精确至0.1 mg)甲醇,1200mg(精确至0.1 mg)正丁醇、异丁醇、氯仿、120 mg(精确至0.1 mg)正己烷和二乙烯苯,100 mg(精确至0.1 mg)甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯于100 mL容量瓶中,用N,N-二甲基甲酰胺定容至刻度 ,摇匀。得甲醇浓度为25 mg/mL、正丁醇、异丁醇、氯仿浓度为12 mg/mL,正己烷和二乙烯苯浓度为1.2 mg/mL,甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯浓度为1mg/mL标准储备液,4°C保存。
3.4.2混合标准中间液:分别准确吸取2.0mL甲醇标准储备液;1.0 mL正丁醇、异丁醇、氯仿、正己烷、二乙烯苯、甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯、标准储备液于同一100 mL 容量瓶中,用50%的N,N-二甲基甲酰胺溶液定容至刻度 ,摇匀。该混合标准中间液中甲醇浓度为500 μg/mL,正丁醇、异丁醇、氯仿浓度为120 μg/mL,正己烷、二乙烯苯浓度为12.0 μg/mL,甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯浓度为10.0 μg/mL。该中间液放置4°C保存。
3.4.3混合标准工作液:准确吸取混合标准中间液0.05 mL、0.20 mL、0.50 mL、1.0 mL、2.0 mL、5.0 mL于10.0 mL 容量瓶中,用50% N,N-二甲基甲酰胺定容,得甲醇浓度为2.50 μg /mL 、10.0 μg/mL、25.0 μg /mL、50.0 μg/mL、100 μg /mL、250 μg/mL,正丁醇、异丁醇、氯仿浓度为0.60 μg /mL 、2.40 μg/mL、6.00 μg /mL、12.0 μg/mL、24.0 μg /mL、60.0 μg/mL,正己烷、二乙烯苯浓度为0.06 μg /mL 、0.24 μg/mL、0.60 μg /mL、1.20 μg/mL、2.40 μg /mL、6.00 μg/mL;甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯浓度为0.05 μg /mL 、0.20 μg/mL、0.50 μg /mL、1.00 μg/mL、2.00 μg /mL、5.00 μg/mL的标准工作液,临用时配制。
4 仪器设备
4.1 气相色谱仪:配有氢火焰离子化检测器( FID)。
4.2 顶空自动进样器。
4.3 顶空瓶:20 mL,配备铝盖和不含烃类溶剂残留的丁基橡胶或硅树脂胶隔垫。
4.4 天平:感量为 1 mg 和 0.1 mg。
4.5 离心机:转速 ≥4000 r/min。
4.6 超声波清洗器。
5 分析步骤
5.1 试样制备
5.1.1 固体基质
称取样品0.5 g (精确到0.001 g) 于20 mL顶空瓶中,加入5 mL50% N,N-二甲基甲酰胺溶液,摇匀后密封,超声处理10 min,即得。
5.1.2 液体基质
称取样品1.0 g至2.0 g (精确到0.001 g) 于10 mL容量瓶中,加入50% N,N-二甲基甲酰胺溶液定容至刻度,摇匀,准确吸取5 mL溶液至20 mL顶空瓶中,密封,即得。
5.2仪器参考条件
5.2.1顶空进样参考条件
a) 平衡时间:30 min。
b) 平衡温度:90 °C。
c) 进样体积:1.0 mL。
5.2.2色谱参考条件
a) 色谱柱:以键合/交联聚乙二醇为固定相的毛细管柱,柱长为30 m,内径为0.32 mm,膜厚度为0.50 μm或性能相当者。
b) 柱温箱温度:起始温度40 °C,保持5 min ,10 °C/min 升温至 150 °C,保持1 min,再以20 °C/min升至200 °C,保持2 min。
c) 进样口温度:200 °C。
d) 分流比:15∶1
e) FID 检测器温度:250°C。
f) 载气:高纯氮气,流量 1.5 mL/min,尾吹 30 mL/min。
g) 氢气流量:40 mL/min。
h) 空气流量:300 mL/min。
5.3 标准曲线的制作
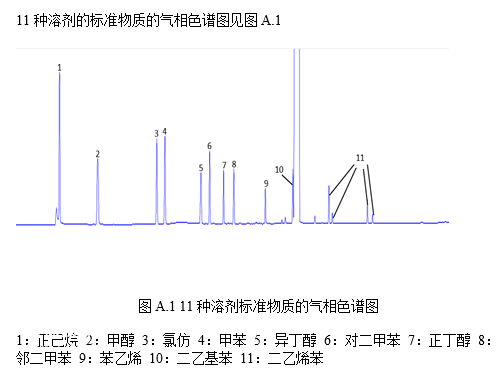
准确吸取3.4.2中各浓度的标准工作溶液5mL置于顶空瓶中,进行气相色谱测定,测得相应的峰面积, 以标准工作液中相应溶剂的浓度为横坐标,以峰面积为纵坐标,绘制标准曲线 (标准溶液气相色谱图见附录 A 中图 A.1 )。
5.4 试验溶液的测定
将5.1中试样待测液进行气相色谱仪测定,以保留时间定性,测得峰面积,根据标准曲线计算试样中各溶剂残留的含量。
6 分析结果的表述
试样中各溶剂残留含量按式(1)计算:
…………………………(1)
式中:
X——试样中各溶剂残留的含量,单位为毫克每千克(mg/kg);
C——由标准曲线查得测定样液中各溶剂残留的浓度,单位为微克每毫升(μg/mL);
m——试样的称样质量,单位为克( g);
V——顶空瓶中供试样溶液的体积,单位为毫升(mL);
计算结果以重复条件下获得的两次独立测定结果的算术平均值表示,保留三位有效数字。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的 15 % 。
8 其他
当称样量为0.5 g 时,甲醇的检出限为4mg/kg,定量限为10 mg/kg,正丁醇、异丁醇、氯仿检出限为2 mg/kg,定量限为6 mg/kg,正己烷、二乙烯苯的检出限为0.2 mg/kg,定量限为0.6 mg/kg,甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯、二乙烯苯检出限为0.08 mg/kg,定量限为0.30 mg/kg。
附录 A
11种溶剂标准物质的典型气相色谱图
第四部分
兴奋剂及违禁成分测定
Determination of Stimulant and
Prohibited Components



第五部分
不同剂型及特定原料类别产品的
卫生学检测项目
Hygienic Testing Items for Products with Different Dosage Formsand Specific Raw Materials

第六部分
特定原料类别产品的功效成分和
标志性成分检测项目
Testing Items for Functional and Iconic Components of Productswith Specific Raw Material


附件2:
portant; word-wrap: break-word !important;">市场监管总局
portant; word-wrap: break-word !important;">2019年6月13日


 揭秘印度生意最火爆的代孕工厂
揭秘印度生意最火爆的代孕工厂 虫草中添加“伟哥”?专家称无检验依据
虫草中添加“伟哥”?专家称无检验依据 火锅、小龙虾越吃越想吃? 地餐馆调料检
火锅、小龙虾越吃越想吃? 地餐馆调料检 实拍妇科实习全程:女人越漂亮越容易得
实拍妇科实习全程:女人越漂亮越容易得 英女子得了“睡美人症” 每天清醒两小时
英女子得了“睡美人症” 每天清醒两小时


 别对疾病的小信号视而不见
别对疾病的小信号视而不见 美容觉可以改善脸色 打鼾却让你老丑笨
美容觉可以改善脸色 打鼾却让你老丑笨 盘点乳房太大对女人带来的健康危害
盘点乳房太大对女人带来的健康危害 罂粟壳吃了有什么感觉
罂粟壳吃了有什么感觉 英国脱欧,对我国营养保健产业的影响
英国脱欧,对我国营养保健产业的影响 雾霾下的自救方案(2017版)
雾霾下的自救方案(2017版) 萨德对中国保健食品的进出口有何影响
萨德对中国保健食品的进出口有何影响 日本核辐射地区生产的食物吃了怎么办
日本核辐射地区生产的食物吃了怎么办 H7N9病毒中话鸡肉 产业安全促发展
H7N9病毒中话鸡肉 产业安全促发展 长三角营养保健产业联盟信息专报(3.15
长三角营养保健产业联盟信息专报(3.15









